Nature子刊:于杰团队等揭示人源牛磺酸转运蛋白TauT的二聚化和底物识别机制
来源:生物世界 2025-07-11 10:31
该研究揭示了脂质微环境对 TauT 寡聚化的重要调控机制,以及 TauT 底物结合、识别和转运的分子机制,将有助于为理解 TauT 功能和探索牛磺酸缺乏相关疾病的潜在治疗策略提供一个结构框架。
牛磺酸是一种含硫 β-氨基酸,广泛分布于神经、视网膜和心肌等高代谢组织。作为身体的“全能辅助“,它具有维持细胞稳定、调节神经传导、促进脂质代谢和抗氧化等重要功能。
随着年龄增长,人体合成牛磺酸能力下降,主要依赖牛磺酸转运蛋白 TauT 从外界摄取。TauT 功能障碍会导致视网膜病变、心肌病、神经系统疾病、代谢失调以及衰老。此外,最新研究发现,TauT 在某些癌症中异常活跃,可能成为新的治疗靶点。
2025 年 7 月 4 日,中国科学院上海有机化学研究所生物与化学交叉研究中心于杰课题组与合作者在 Nature Communications 期刊发表了题为:Dimerization and substrate recognition of human taurine transporter 的研究论文。
该研究通过冷冻电镜首次发现人源 TauT 在纳米盘环境中以多种聚合状态存在,并解析其单体和二聚体的高分辨率结构。

该研究发现二聚体结合方式与 SLC6 家族中单胺转运体 NET 的二聚体明显不同,呈现出一种全新的二聚化方式。TauT 的二聚化界面是由两个单体的 TM5 螺旋介导,而两个胆固醇分子的结合进一步的促进了二聚化的形成。除单体和二聚体外,二维分类中还发现了少量可能代表三聚体和四聚体的颗粒,表明了 TauT 在天然膜环境中可能以多种寡聚状态存在。研究团队认为,胆固醇在其中充当“分子胶水”,介导了 TauT 的寡聚化组装(图1)。
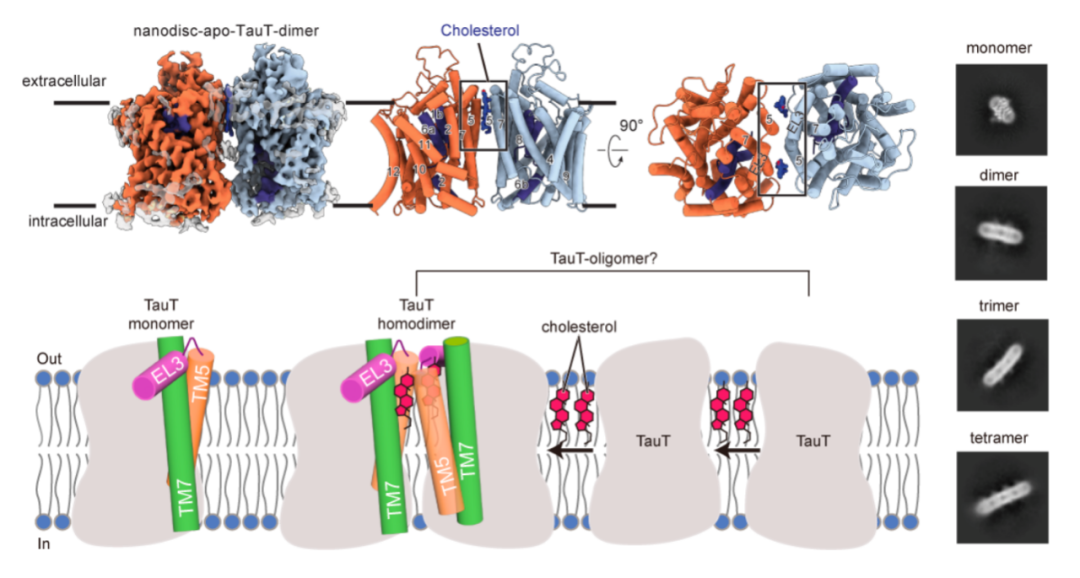 图1. 胆固醇介导的TauT寡聚物组装模型
图1. 胆固醇介导的TauT寡聚物组装模型
该研究报道了 TauT 在 apo 状态、底物牛磺酸或 GABA 结合状态下的冷冻电镜结构。结合分子动力学模拟和功能实验,研究团队阐明了 TauT 对底物特异性识别和转运的详细机制。其中心位点可同时结合 1 个底物、2 个 Na⁺ 和 1 个 Cl⁻,诱导构象由开放态转为闭合态。在闭合状态下,两个独特高度不保守的残基 Gly57 和 Phe58 位于底物结合口袋内,主要决定了 TauT 的底物特异性。当底物释放时,Gly57 和 Phe58 产生明显的构象变化,使底物和两个 Na⁺ 得以释放到细胞质侧(图2)。
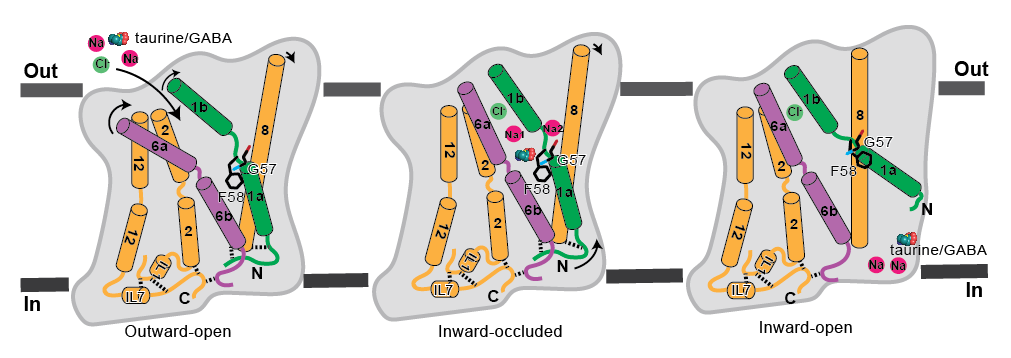 图2. TauT 识别和转运底物的分子机制
图2. TauT 识别和转运底物的分子机制
近年来,由于牛磺酸在人类健康和疾病的许多方面发挥着重要作用,人们对牛磺酸的兴趣日益浓厚。该研究揭示了脂质微环境对 TauT 寡聚化的重要调控机制,以及 TauT 底物结合、识别和转运的分子机制,将有助于为理解 TauT 功能和探索牛磺酸缺乏相关疾病的潜在治疗策略提供一个结构框架。
中国科学院上海有机化学研究所生物与化学交叉研究中心博士研究生张一敏、陈佳慧为论文共同第一作者,于杰研究员、盖景鹏教授和杨冬雪研究员为论文共同通讯作者,有机所交叉中心朱正江研究员以及本文其他作者也做出了重要贡献。该工作由上海临港实验室、上海市基础研究先导项目、上海科技大学启动基金和上海浦江计划资助。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


